| |
данная статья в pdf (510 кб)
Методические рекомендации для врачей
Автор: Марианна Иванова ,
врач-офтальмолог, к.м.н.,
основатель проекта www.oftalmic.ru
Глаукома – это атрофия зрительного нерва и сужение полей зрения при повышенных или нормальных цифрах внутриглазного давления (ВГД). В России около 1 миллиона человек страдает глаукомой, в мире насчитывается 67 миллионов людей с диагнозом глаукома (Gibson J. 2012). Глаукома – весьма разнородное по этиологии заболевание, причинами которого могут быть: травма глаза, особое строение глаза (при закрытоугольной глаукоме), катаракта (когда мутный набухающий хрусталик затрудняет пути оттока внутриглазной жидкости – ВГЖ), генетические нарушения, приводящие к синтезу патологических белков, затрудняющих отток жидкости из глаза, гипоксические процессы в глазу и множество других факторов. Результат прогрессирования глаукомы – это необратимая атрофия волокон зрительного нерва либо вследствие затрудненного оттока ВГЖ из глаза и повышения давления в глазу, либо вследствие действия других факторов, приводящих к атрофии без выраженного повышения ВГД.
В России множество исследователей и практикующих врачей направляют свои усилия на поиск эффективных способов лечения и предотвращения развития глаукомы. На сегодняшний день при анализе генома человека найдены несколько десятков участков (локусов) ДНК, изменения в которых вызывают глаукому (табл. 1).
Таблица 1. Гены, ассоциированные с развитием ПОУГ (Fuse N ., 2010)
Символ гена |
Название гена |
MIM # |
Расположение гена |
Ссылка |
AGTR2 |
Angiotensin II receptor, type 2 |
300034 |
Xq22-q23 |
(Hashiz ume et al . 2005) |
ANP |
Atrial natriuretic peptide |
108780 |
1p36.2 |
(Tunny et al . 1996) |
APOE |
Apolipoprotein E |
107741 |
19q13.2 |
(Copin et al . 2002) |
CDKN1A |
Cyclin-dependent kinase inhibitor 1A |
116899 |
6p21.2 |
(Tsai et al . 2004) |
CDH-1 |
E-cadherin |
192090 |
16q22.1 |
(Lin et al . 2006) |
CYP1B1 |
Cytochrome P450, subfamily I, polypeptide 1 |
601771 |
2p22-p21 |
(Vincent et al . 2002) |
EDNRA |
Endothelin receptor, type A |
131243 |
4q31.2 |
(Ishikawa et al . 2005) |
GPDS1 |
Glaucoma-related pigment dispersion syndrome |
600510 |
7q35-q36 |
(Nakamura et al . 2009) |
GSTM1 |
Glutathione S-transferase, mu-1 |
138350 |
1p13.3 |
(Juronen et al . 2000) |
HSPA1A |
Heat-shock 70kD protein 1A |
140550 |
6p21.3 |
(Tosaka et al . 2007) |
IGF2 |
Insulin-like growth factor II |
147470 |
11p15.5 |
(Tsai et al . 2003) |
IL1 ? |
Interleukin 1-beta |
147720 |
2q14 |
(Lin et al . 2003) |
MFN1 |
Mitofusin 1 |
608506 |
3q25-q26 |
(Wolf et al . 2009) |
MFN2 |
Mitofusin 2 |
608507 |
1p36.2 |
(Wolf et al . 2009) |
MTHFR |
5,10-methylenetetrahydrofolate reductase |
607093 |
1p36.3 |
(Junemann et al . 2005) |
NCK2 |
NCK adaptor protein 2 |
604930 |
2q12 |
(Akiyama et al . 2008) |
NOS3 |
Nitric oxide synthase 3 |
163729 |
7q36 |
(Tunny et al . 1998) |
NTF4 |
Neurotrophin 4 |
162662 |
19q13.3 |
(Pasutto et al . 2009) |
OCLM |
Oculomedin |
604301 |
1q31.1 |
(Fujiwara et al . 2003) |
OLFM2 |
noelin 2 |
ID: 93145 |
19p13.2 |
(Funayama et al . 2006) |
OPA1 |
Optic atrophy 1 |
605290 |
3q28-q29 |
(Aung et al . 2002) |
PARL |
presenilin associated, rhomboid-like |
607858 |
3q27 |
(Wolf et al . 2009) |
PON1 |
Paraoxonase 1 |
168820 |
7q21.3 |
(Inagaki et al . 2006) |
TAP1 |
Transporter, ATP-binding cassette, major histocompatibility complex, 1 |
170260 |
6p21.3 |
(Lin et al . 2004) |
TLR4 |
Toll-like receptor 4 |
603030 |
9q32-q33 |
(Shibuya et al . 2008) |
TNF |
Tumor necrosis factor |
191160 |
6p21.3 |
(Lin et al . 2003a) |
TP53 |
Tumor protein p53 |
191170 |
17p13.1 |
(Lin et al . 2002) |
Механизмы, по которым развивается болезнь при найденных мутациях, во многих случаях неясен. Однако есть несколько генов, для которых лучше, чем для остальных изучены причинно-следственные взаимосвязи при патогенезе глаукомы. Это гены миоцилина ( MYOC ), оптиневрина (OPTN), цитохрома P450 первого семейства подсемейства B полипептид 1 (CYP1B1), WD повторяющегося домена 36 (WDR36) и нейротрофина 4 (NTF4). О первых трех из них и пойдет речь в данной статье.
1. Характеристика гена миоцилина
Ген миоцилина расположен на длинном плече 1-ой хромосомы (локус 1q24.3-q25.2), был впервые описан Stone в 1997 году, имеет размер 17217 пар нуклеотидов (обозначают обычно в тысячах пар нуклеотидов, называя их килобазами), то есть 17,22 кб, состоит из промотерной (начальной) части, трех экзонов: N -концевой миозин-подобный домен, С-концевой ольфактомедин-подобный домен и средний домен - связка, а также двух длинных интронных областей. С гена миоцилина считывается полипептид длиной 504 аминокислоты. Подавляющее большинство мутаций в гене, вызывающих развитие глаукомы, находятся в третьем длинном ольфактомедин-подобном экзоне. В норме ген экспрессируется главным образом в сетчатке.
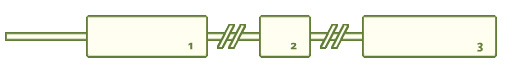
Рис. 1. Ген миоцилина, myocilin ( MYOC )
2. Функция белка, синтезируемого с гена MYOC в норме и при мутациях
Миоцилин – гидрофобный белок, который был найден практически во всех тканях организма (цилиарное тело, сфинктер зрачка, сетчатка, склелетные мышцы, сердце и др.), В норме белок существует в виде гомодимера, взаимодействует с ольфактомедином (ноэлин-3), считывающимся с гена OLFM 3. В клетке располагается в области шероховатого эндоплазматического ретикулума в большом количестве в клетках фоторецепторов. Основное количество белка в норме обнаружено в области трабекулярного аппарата глаза, передней и увеальной его части. При глаукоме белок миоцилин обнаруживают в значительно увеличенных количествах, причем во всех частях трабекулярного аппарата, не зависимо от степени выраженности клинических проявлений глаукомы. Для миоцилина характерна посттрансляционная модификация, «созревание» белка после его синтеза путем присоединения остатков углеводов (гликозилирование) или пальмитиновой кислоты (пальмитилирование).
 
Рис. 2. Желтым показан миозин-подобный участок белка миоцилина «лейциновые молнии», голубым показан ольфактомедин-подобный участок миоцилина (один из них с красной полосой мутирован) и красный соединительный фрагмент между этими участками.
Регуляция цитоскелета и клеточная миграция
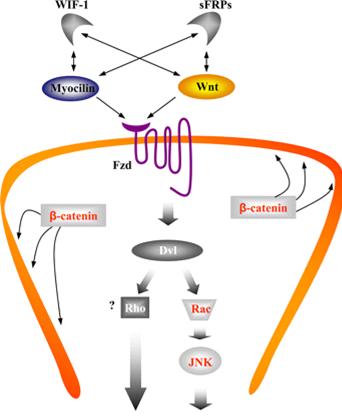
Рис. 3. Схематическая диаграмма роли миоцилина в клетке.
Миоцилин является модулятором Wnt сигнального пути (от рецепторов на поверхности клетки до экспрессии ДНК в ядре), который отвечает за межклеточные взаимодействия в эмбриогенезе и во взрослом организме. Миоцилин может связываться с Wnt антагонистами WIF-1 и sFRPs и конкурировать с Wnt за связывание с некоторыми Fzd рецепторами. Белки, на которые действует миоцилин, на рисунке 3 показаны красным. Тонкие непрерывные линии с двумя стрелками показывают белки, которые взаимодействуют друг с другом. Подробнее об этом в публикациях Kwon HS 2009, 2011. Таким образом, важно понимать, что миоцилин участвует
- в реорганизации актинового цитоскелета клетки
- в миграции клеток
- в межклеточных взаимодействиях.
На сегодняшний день в pubmed.com около 500 публикаций, описывающих свойства и функции миоцилина.
3. Какую роль играет миоцилин в развитии глаукомы
До сих пор ясного понимания роли миоцилина в патогенезе глаукомы нет. Предполагалось, что при мутациях, изменяющих заряд на поверхности белка или 3 D -структуру белка, у миоцилина появляется тенденция к формированию конгломератов, состоящих из десятков и сотен молекул, которые, попадая в трабекулярную сеть, своим размером засоряют ее и затрудняют отток внутриглазной жидкости, однако гистологически данная гипотеза не была подтверждена. Поэтому сейчас преобладает теория, по которой мутантный миоцилин образует не гомодимеры, а гетеродимеры, например, с кальпаином II , что приводит к накоплению в эндоплазматическом ретикулуме и секреции в экстраклеточный матрикс мутантных гетероолигомеров с измененной функцией, которые, изменяют свойства клеток трабекулярного аппарата и как следствие отток ВГЖ. Показано, что к сходным процессам приводит появление мутантного миоцилина в почках, приводя к мезангиопролиферативному гломерулонефриту (Goldwich A ., 2005)

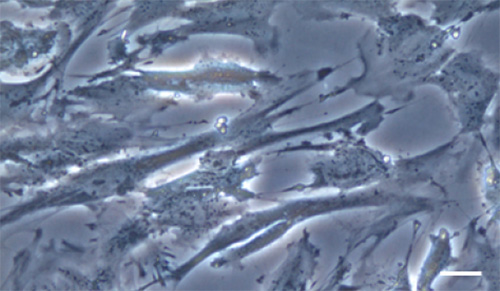
Рис. 4. Цитотоксичность мутированного миоцилина.
На верхнем рисунке показаны клетки трабекулярного аппарата в норме. На нижнем рисунке показаны те же клетки после действия на них в течение 24 часов
На рис. 4 вверху показаны клетки трабекулярного аппарата в норме, внизу показаны те же клетки после действия на них в течение 24 часов укороченного миоцилина при замене аминокислоты пролин на лейцин в 370-й позиции (Yuan He , 2009). Авторы статьи, таким образом, показывают наличие цитотоксичности мутированного миоцилина.
Наша задача – выяснить, есть ли полиморфизмы и делеции/дупликации в гене миоцилина у пациента, или нет. И если есть, что в этом случае делать? Для начала рассмотрим, какие мутации в гене миоцилина уже известны.
4. Описанные мутации в гене миоцилина
- частота мутаций
- особенности российской популяции
- серьезность последствий различных мутаций
Показано, что мутации в гене миоцилина приводят к развитию врожденной и ювенильной глаукомы и встречаются в 2 – 10% случаев у пациентов с первичной открытоугольной глаукомой. Единичные исследования, проводимые в России (
Астахов Ю.С., Васильев В.Б., Рахманов В.В., 2005, Бикбов М.М., Суркова В.К. и др. 2010), не дают достаточно материала для оценки особенностей в вариациях гена в Российской популяции. Необходимо создание референсной базы населения России для выявления патогенных и нейтральных полиморфизмов.
Основную долю описанных в мировой базе мутаций миоцилина составляют миссенс (83%) и нонсенс (6,4%) мутации. Малые (меньше 21 пары нуклеотидов) делеции, вставки и комбинация вставка/делеция составляют соответственно 4,3%, 5,3% и 1,1%. (Рис. 5)
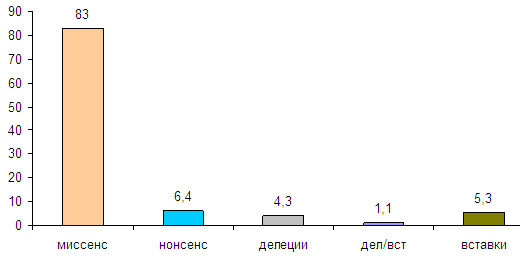
Рис. 5. Спектр мутаций, описанных в гене миоцилина (MYOC)
Несколько сотен полиморфизмов, описанных для миоцилина, собраны в базе данных: myocilin.com/variants.php. Так как данная статья посвящена поиску изменений в геноме, приводящих к глаукоме, считаю уместным в качестве примера привести здесь полную таблицу (табл. 2) мутаций миоцилина, ведущих к глаукоме (95 шт), нейтральных полиморфизмов (146) и замен с недоказанной патогенностью (18):
Таблица 2. Полиморфизмы, описанные в гене миоцилина
Положение |
Замена аминокислоты |
Нуклеотидная замена |
Вызывает ли глаукому |
Промотер |
– |
-2084g>t |
Нейтральный полиморфизм |
Промотер |
– |
-1770g>a |
Нейтральный полиморфизм |
Промотер |
– |
-1760ins_a |
Нейтральный полиморфизм |
Промотер |
– |
-1422g>t |
Нейтральный полиморфизм |
Промотер |
– |
-1378ins_t |
Нейтральный полиморфизм |
Промотер |
– |
-1340del_a |
Нейтральный полиморфизм |
Промотер |
– |
-1333g>a |
Нейтральный полиморфизм |
Промотер |
– |
-1081a>g |
Нейтральный полиморфизм |
Промотер |
– |
-1000c>g |
Нейтральный полиморфизм |
Промотер |
– |
-700_-699ins |
Нейтральный полиморфизм |
Промотер |
– |
-467gt>ca |
Нейтральный полиморфизм |
Промотер |
– |
-387c>t |
Нейтральный полиморфизм |
Промотер |
– |
-339gt11-19 |
Нейтральный полиморфизм |
Промотер |
– |
-320c>t |
Нейтральный полиморфизм |
Промотер |
– |
-315g>a |
Нейтральный полиморфизм |
Промотер |
– |
-306g>a |
Нейтральный полиморфизм |
Промотер |
– |
-306g>t |
Нейтральный полиморфизм |
Промотер |
– |
-255t>c |
Нейтральный полиморфизм |
Промотер |
– |
-241g>a |
Нейтральный полиморфизм |
Промотер |
– |
-224t>c |
Нейтральный полиморфизм |
Промотер |
– |
-190g>t |
Нейтральный полиморфизм |
Промотер |
– |
-159t>c |
Нейтральный полиморфизм |
Промотер |
– |
-153t>c |
Нейтральный полиморфизм |
Промотер |
– |
-127t>c |
Нейтральный полиморфизм |
Промотер |
– |
-126t>g |
Нейтральный полиморфизм |
Промотер |
– |
-126t>c |
Нейтральный полиморфизм |
Промотер |
– |
-92_-91del_ct |
Нейтральный полиморфизм |
Промотер |
– |
-83g>a |
Нейтральный полиморфизм |
Промотер |
– |
-78t>g |
Нейтральный полиморфизм |
Промотер |
– |
-77g>a |
Нейтральный полиморфизм |
Промотер |
– |
-18c>t |
Нейтральный полиморфизм |
Промотер |
– |
-8c>t |
Нейтральный полиморфизм |
Экзон 1 |
Phe4Ser |
11T>C |
Нейтральный полиморфизм |
Экзон 1 |
Cys8X |
24C>A |
Мутация, приводящая к глаукоме |
Экзон 1 |
Cys9Ser |
26G>C |
Нейтральный полиморфизм |
Экзон 1 |
Gly12Arg |
34G>C |
Нейтральный полиморфизм |
Экзон 1 |
Pro13Leu |
38C>T |
Патогенность не доказана |
Экзон 1 |
Pro13Pro |
39T>G |
Нейтральный полиморфизм |
Экзон 1 |
Pro16Leu |
47C>T |
Нейтральный полиморфизм |
Экзон 1 |
Ala17Ser |
49G>T |
Нейтральный полиморфизм |
Экзон 1 |
Val18Leu |
52G>T |
Нейтральный полиморфизм |
Экзон 1 |
Cys25SerfsX65 |
56_72dup |
Мутация, приводящая к глаукоме |
Экзон 1 |
Gln19His |
57G>T |
Нейтральный полиморфизм |
Экзон 1 |
Cys25Arg |
73T>C |
Мутация, приводящая к глаукоме |
Экзон 1 |
Arg33Lys |
98G>A |
Патогенность не доказана |
Экзон 1 |
Arg46X |
136C>T |
Нейтральный полиморфизм |
Экзон 1 |
Gln48His |
144G>T |
Патогенность не доказана |
Экзон 1 |
Val53Ala |
158T>C |
Мутация, приводящая к глаукоме |
Экзон 1 |
Ser55Thr |
164G>C |
Нейтральный полиморфизм |
Экзон 1 |
Asn57Asp |
169A>G |
Нейтральный полиморфизм |
Экзон 1 |
Ser69Ser |
Не определено |
Нейтральный полиморфизм |
Экзон 1 |
Val70Val |
210C>T |
Нейтральный полиморфизм |
Экзон 1 |
Asn73Ser |
218A>G |
Нейтральный полиморфизм |
Экзон 1 |
Arg76Lys |
227G>A |
Нейтральный полиморфизм |
Экзон 1 |
Asp77Glu |
Не определено |
Нейтральный полиморфизм |
Экзон 1 |
Arg82Cys |
244C>T |
Мутация, приводящая к глаукоме |
Экзон 1 |
Arg82His |
245G>A |
Нейтральный полиморфизм |
Экзон 1 |
Thr88Thr |
Не определено |
Нейтральный полиморфизм |
Экзон 1 |
Arg91X |
271C>T |
Мутация, приводящая к глаукоме |
Экзон 1 |
Leu95Pro |
284T>C |
Нейтральный полиморфизм |
Экзон 1 |
Glu96Glu |
288G>A |
Нейтральный полиморфизм |
Экзон 1 |
Gln101Gln |
303A>G |
Нейтральный полиморфизм |
Экзон 1 |
Thr103Thr |
309C>T |
Нейтральный полиморфизм |
Экзон 1 |
Ala108Gly |
323C>G |
Нейтральный полиморфизм |
Экзон 1 |
Gln118Leu |
353A>T |
Нейтральный полиморфизм |
Экзон 1 |
Gly122Gly |
366C>T |
Нейтральный полиморфизм |
Экзон 1 |
Gly122Gly |
366C>A |
Нейтральный полиморфизм |
Экзон 1 |
Thr123Thr |
369C>T |
Нейтральный полиморфизм |
Экзон 1 |
Leu124Leu |
372G>C |
Нейтральный полиморфизм |
Экзон 1 |
Arg125SerfsX158 |
375delG |
Мутация, приводящая к глаукоме |
Экзон 1 |
Arg126Trp |
376C>T |
Мутация, приводящая к глаукоме |
Экзон 1 |
Arg126Gln |
377G>A |
Нейтральный полиморфизм |
Экзон 1 |
Arg128Arg |
384G>C |
Нейтральный полиморфизм |
Экзон 1 |
Gln134Gln |
402A>G |
Нейтральный полиморфизм |
Экзон 1 |
Thr135Ile |
404C>T |
Нейтральный полиморфизм |
Экзон 1 |
Thr140Ser |
419C>G |
Патогенность не доказана |
Экзон 1 |
Ala141Ala |
425C>T |
Нейтральный полиморфизм |
Экзон 1 |
Arg158Gln |
473G>A |
Патогенность не доказана |
Экзон 1 |
Leu159Leu |
477A>G |
Нейтральный полиморфизм |
Экзон 1 |
Gln161Arg |
482A>G |
Нейтральный полиморфизм |
Экзон 1 |
Glu162dup |
484_486dup |
Мутация, приводящая к глаукоме |
Экзон 1 |
Leu166Leu |
498G>C |
Нейтральный полиморфизм |
Экзон 1 |
Arg168Arg |
504G>A |
Нейтральный полиморфизм |
Экзон 1 |
Leu180Leu |
Не определено |
Нейтральный полиморфизм |
Экзон 1 |
Gly183Ser |
547G>A |
Нейтральный полиморфизм |
Экзон 1 |
Arg189Gln |
566G>A |
Нейтральный полиморфизм |
Интрон 1 |
– |
604+13a>c |
Нейтральный полиморфизм |
Интрон 1 |
– |
604+14g>a |
Нейтральный полиморфизм |
Интрон 1 |
– |
604+16g>t |
Нейтральный полиморфизм |
Интрон 1 |
– |
604+19g>c |
Нейтральный полиморфизм |
Интрон 1 |
– |
604+50g>a |
Нейтральный полиморфизм |
Интрон 1 |
– |
604+228a>t |
Нейтральный полиморфизм |
Экзон 2 |
Ser203Phe |
608C>T |
Нейтральный полиморфизм |
Экзон 2 |
Thr204Met |
611C>T |
Нейтральный полиморфизм |
Экзон 2 |
Thr204Thr |
612G>T |
Нейтральный полиморфизм |
Экзон 2 |
Asp208Glu |
624C>G |
Нейтральный полиморфизм |
Экзон 2 |
Thr209Asn |
626C>A |
Патогенность не доказана |
Экзон 2 |
Leu215Pro |
644T>C |
Нейтральный полиморфизм |
Экзон 2 |
Leu215Gln |
644T>A |
Мутация, приводящая к глаукоме |
Экзон 2 |
Lys216Lys |
648G>A |
Нейтральный полиморфизм |
Экзон 2 |
Glu218Glu |
654G>A |
Нейтральный полиморфизм |
Экзон 2 |
Arg226Gln |
677G>A |
Нейтральный полиморфизм |
Экзон 2 |
Leu228Ser |
683T>C |
Патогенность не доказана |
Экзон 2 |
Glu230Lys |
688G>A |
Патогенность не доказана |
Экзон 2 |
Glu240Gly |
719A>G |
Патогенность не доказана |
Экзон 2 |
Thr243Thr |
Не определено |
Нейтральный полиморфизм |
Интрон 2 |
– |
730+3a>g |
Нейтральный полиморфизм |
Интрон 2 |
– |
730+35g>a |
Нейтральный полиморфизм |
Интрон 2 |
– |
730+172c>a |
Нейтральный полиморфизм |
Интрон 2 |
– |
731-73c>t |
Нейтральный полиморфизм |
Интрон 2 |
– |
731-23g>a |
Нейтральный полиморфизм |
Экзон 3 |
Gly244Ser |
730G>A |
Нейтральный полиморфизм |
Экзон 3 |
Gly244Val |
731G>T |
Нейтральный полиморфизм |
Экзон 3 |
Cys245Tyr |
734G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly246Arg |
736G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp247X |
739G>T |
Патогенность не доказана |
Экзон 3 |
Val251Ala |
752T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly252Arg |
754G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr256Met |
767C>T |
Нейтральный полиморфизм |
Экзон 3 |
Ala260Ala |
780A>G |
Нейтральный полиморфизм |
Экзон 3 |
Glu261Lys |
781G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Lys266Lys |
798G>A |
Нейтральный полиморфизм |
Экзон 3 |
Arg272X |
814C>T |
Патогенность не доказана |
Экзон 3 |
Arg272Gly |
814C>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Arg272Arg |
816A>T |
Нейтральный полиморфизм |
Экзон 3 |
Asp273AspfsX344 |
819delC |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro274Arg |
821C>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr285Met |
854C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr285Thr |
855G>T |
Нейтральный полиморфизм |
Экзон 3 |
Trp286Arg |
856T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ile288Ile |
864C>T |
Нейтральный полиморфизм |
Экзон 3 |
Ile288Met |
864C>G |
Нейтральный полиморфизм |
Экзон 3 |
Thr290Ala |
868A>G |
Нейтральный полиморфизм |
Экзон 3 |
Thr293Lys |
878C>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr293Thr |
879G>A |
Нейтральный полиморфизм |
Экзон 3 |
Arg296Cys |
886C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gln297His |
893G>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Glu300Lys |
898G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp302Asp |
906G>T |
Нейтральный полиморфизм |
Экзон 3 |
Ile304Ile |
Не определено |
Нейтральный полиморфизм |
Экзон 3 |
Gln309Gln |
927G>A |
Нейтральный полиморфизм |
Экзон 3 |
Ser313Phe |
938C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Leu318Leu |
952C>T |
Нейтральный полиморфизм |
Экзон 3 |
Glu323Lys |
967G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr325Thr |
975G>A |
Нейтральный полиморфизм |
Экзон 3 |
Gly326Ser |
976G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Val329Met |
985G>A |
Нейтральный полиморфизм |
Экзон 3 |
Val329Val |
Не определено |
Нейтральный полиморфизм |
Экзон 3 |
Ser331Thr |
991T>A |
Патогенность не доказана |
Экзон 3 |
Ser331Ser |
Не определено |
Нейтральный полиморфизм |
Экзон 3 |
Ser331Leu |
992C>T |
Патогенность не доказана |
Экзон 3 |
Ser333Cys |
997A>T |
Нейтральный полиморфизм |
Экзон 3 |
Leu334Pro |
1001T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Phe336Phe |
1008C>T |
Нейтральный полиморфизм |
Экзон 3 |
Gln337X |
1009Cdel |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gln337Glu |
1009C>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gln337Arg |
1010A>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp338Asn |
1014G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ser341Pro |
1021T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Arg342Lys |
1025G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ile345Met |
1035A>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Arg346Thr |
1037G>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Tyr347Tyr |
1041T>C |
Нейтральный полиморфизм |
Экзон 3 |
Tyr347X |
1041T>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr351Thr |
1053C>T |
Нейтральный полиморфизм |
Экзон 3 |
Glu352Lys |
1054G>A |
Нейтральный полиморфизм |
Экзон 3 |
Thr353Ile |
1058C>T |
Патогенность не доказана |
Экзон 3 |
Ille360Asn |
1079T>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro361Ser |
1081C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly362GlufsX45 |
1085delG |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ala363Thr |
1087G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly364Val |
1091G>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly367Arg |
1099G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gln368SerfsX38 |
1100_1103delGACAinsT |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gln368X |
1102C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Phe369Leu |
1105T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro370Leu |
1109C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro370Pro |
1110G>A |
Нейтральный полиморфизм |
Экзон 3 |
Tyr371Asp |
1111T>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly374Val |
1121G>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr377Met |
1130C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr377Lys |
1130C>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr377Thr |
Не определено |
Нейтральный полиморфизм |
Экзон 3 |
Asp380Gly |
1138G>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp380His |
1138G>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp380Asn |
1138G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp380Ala |
1139A>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp384Asn |
1150G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp384Gly |
1151A>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ser393Asn |
1178G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ser393Arg |
1179C>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr394Thr |
1182C>T |
Нейтральный полиморфизм |
Экзон 3 |
Asp395Glu |
1185T>G |
Нейтральный полиморфизм |
Экзон 3 |
Glu396dup |
1186_1188dup |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp395_Glu396insAspPro |
1187_1188insCCCAGA |
Мутация, приводящая к глаукоме |
Экзон 3 |
Glu396Glu |
1188G>A |
Нейтральный полиморфизм |
Экзон 3 |
Lys398Arg |
1193A>G |
Нейтральный полиморфизм |
Экзон 3 |
Gly399Val |
1196G>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly399Asp |
1196G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Val402Ile |
1204G>A |
Нейтральный полиморфизм |
Экзон 3 |
Leu403Leu |
1209C>T |
Нейтральный полиморфизм |
Экзон 3 |
Leu413Leu |
1239C>T |
Нейтральный полиморфизм |
Экзон 3 |
Glu414Lys |
1240G>A |
Нейтральный полиморфизм |
Экзон 3 |
Arg422Cys |
1264C>T |
Нейтральный полиморфизм |
Экзон 3 |
Arg422His |
1265G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Lys423Glu |
1267A>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ser425Pro |
1273T>C |
Нейтральный полиморфизм |
Экзон 3 |
Ser425X |
1274C>G |
Патогенность не доказана |
Экзон 3 |
Val426Phe |
1276G>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Val426Val |
1278C>T |
Нейтральный полиморфизм |
Экзон 3 |
Ala427Thr |
1279G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asn428Ser |
1283A>G |
Нейтральный полиморфизм |
Экзон 3 |
Phe430Leu |
1288T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Cys433Arg |
1297T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly434Ser |
1300G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly434Gly |
1303C>T |
Нейтральный полиморфизм |
Экзон 3 |
Tyr437His |
1309T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr438Ile |
1313C>T |
Нейтральный полиморфизм |
Экзон 3 |
Thr438Thr |
Не определено |
Нейтральный полиморфизм |
Экзон 3 |
Val439Val |
1317C>T |
Нейтральный полиморфизм |
Экзон 3 |
Val439Val |
1317C>G |
Нейтральный полиморфизм |
Экзон 3 |
Ala445Val |
1334C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asp446Tyr |
1336G>T |
Нейтральный полиморфизм |
Экзон 3 |
Ala447Val |
1340C>T |
Патогенность не доказана |
Экзон 3 |
Thr448Pro |
1342A>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asn450Asp |
1348A>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Arg450Tyr |
1348A>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Tyr453MetfsX11 |
1357delT |
Мутация, приводящая к глаукоме |
Экзон 3 |
Thr455Lys |
1364C>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Gly458Asp |
1373G>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ile465Met |
1395C>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Arg470Cys |
1408C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Arg470His |
1409G>A |
Нейтральный полиморфизм |
Экзон 3 |
Tyr471Cys |
1412A>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Tyr473Cys |
1418A>G |
Нейтральный полиморфизм |
Экзон 3 |
Met476Arg |
1427T>G |
Нейтральный полиморфизм |
Экзон 3 |
Ile477Asn |
1430T>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ile477Ser |
1430T>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Tyr479His |
1435T>C |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asn480Lys |
1440C>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Asn480Lys |
1440C>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro481Thr |
1441C>A |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro481Ser |
1441C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro481Arg |
1442C>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Pro481Leu |
1442C>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Glu483X |
1447G>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ala488Ala |
1464C>T |
Нейтральный полиморфизм |
Экзон 3 |
Val495Ile |
1483G>A |
Нейтральный полиморфизм |
Экзон 3 |
Ile499Phe |
1495A>T |
Мутация, приводящая к глаукоме |
Экзон 3 |
Ile499Ser |
1496T>G |
Мутация, приводящая к глаукоме |
Экзон 3 |
Lys500Arg |
1499A>G |
Патогенность не доказана |
Экзон 3 |
Ser502Pro |
1504T>C |
Мутация, приводящая к глаукоме |
|
|
– |
*4g>c |
Нейтральный полиморфизм |
|
– |
*20a>g |
Нейтральный полиморфизм |
|
– |
*73g>c |
Нейтральный полиморфизм |
|
– |
*291a>g |
Нейтральный полиморфизм |
|
1544ins489X |
1544insC |
Мутация, приводящая к глаукоме |
|
|
1q24.3_1q31.2del |
– |
Патогенность не доказана |
|
1q23_1q25del |
– |
Нейтральный полиморфизм |
Мутациями в гене миоцилина, приводящими к самой тяжелой клинической картине, являются те, которые приводят к обрыву цепи (всего их описано четыре: rs139804296, rs74315329, rs143413116, rs74315337 в положениях 171605329, 171605478, 171621481 и 171621616 соответственно), а также 46 миссенс вариантов – ведущих к изменению структуры считываемого белка (список их можно легко найти в базе данных ensembl.org, подробнее на странице www .oftalmic.ru/pubmed-gene-manual.php)
5. Подходы к лечению генетических аномалий в гене MYOC
Мы добрались до самого интересного и самого главного. Как, используя новый инструмент, генетическую диагностику, подходить к индивидуальному, эффективному, направленному на устранение причины глаукомы лечению наших пациентов?
В последние годы в англоязычной литературе появился целый шквал публикаций о новых попытках и подходах к молекулярно-генетическим способам лечения болезней, часто совмещая достижения в технологии, молекулярной биологии и генетике. Что касается конкретного вопроса лечения миоцилиновой глаукомы (с позволения, назовем ее так), то действенных методов пока не так много. Проводятся единичные клинические испытания в США, оценивающие эффективность блокировки гена миоцилина короткоцепочечными РНК.
Разберем общую суть предлагаемого лечения, хотя, конечно же, в данной публикации множество деталей будет упущено из виду, однако они будут рассмотрены в дальнейших публикациях. Мне очень импонирует изящность предлагаемого способа лечения.
В виде глазных капель (!) подбирают короткоцепочечные фрагменты РНК, (в англоязычной литературе short interfering – siRNA), последовательность их известна, представлена ниже на рис.5. Должным образом упакованные (в липосомы или полиамидоаминовые дендримеры – наночастицы для целевой доставки действующего вещества к нужным клеткам, подробнее о них здесь: www .oftalmic.ru/b_retinoblastoma.php) их закапывают в глаза.
Таблица 3. короткоцепочечные РНК, применяемые для генетического лечения миоцилиновой глаукомы
Контроль |
5'-aacagtcgcgtttgcgactgg- 3' |
siMYOC-A |
5'-aacttacagagagagacagcagc- 3' |
siMYOC-B |
5'-aataccgagacagtgaaggct- 3' |
siMYOC-C |
5'-aacatccgtaagcagtcagtc- 3' |
siMYOC-D |
5'-aaccccctggagaagaagctc- 3' |
В клетках трабекулярного аппарата и сетчатки эти siРНК комплиментарно связываются с участками гена миоцилина (так как они специальным образом подобраны именно под этот ген), не давая производить мРНК и останавливая синтез мутированного гена миоцилина. Данный способ описан в американском патенте US7700575. Далее возможны варианты. Либо на этом останавливаются, так как терапевтический эффект достигнут – при таком подходе блокируется синтез не всего, но значительной части измененного миоцилина, так что при гаплонедостаточности (когда поврежден только один аллель миоцилина, второй функционирует нормально) этот метод эффективен, прогрессирование глаукомы практически останавливается. Либо вторым этапом можно внедрять вектор со здоровым геном миоцилина, данный подход будет иметь смысл при гомозиготном состоянии, когда оба аллеля миоцилина повреждены. Данный вопрос – тема дальнейших публикаций, а пока, согласитесь, изящный метод?
По аналогичной схеме, только более кратко, будут рассмотрены мутации в гене CYP1B1 и OPTN .
1. Характеристика гена
Ген цитохрома расположен на коротком плече 2-й хромосомы в локусе 2p22.2, длиной 8,58 кб, имеет 3 экзона, впервые был описан в начале 1990-х в группе профессора Burke , секвенирован и опубликован под данным названием в 2001 году группой исследователей проекта «Геном человека» Nature 409 (6822), 860-921 (2001) PMID 11237011. Кодирует 1 из 57 мембран-связанных ферментов гем-тиолатных (обычно от цистеинового остатка) монооксигеназ семейства цитохромов P450 подсемейства B полипептид 1, участвующих во многих каталитических реакциях, в том числе в синтезе холестерина, стероидов и других липидов, витамина D , а также в метаболизме лекарств.

Рис. 6. Три экзона гена цитохрома CYP1B1
2. Функция белка, синтезируемого с гена CYP1B1 в норме и при мутациях
Фермент, кодируемый этим геном, располагается в эндоплазматическом ретикулуме и Фермент, кодируемый этим геном, располагается в эндоплазматическом ретикулуме и метаболизирует проонкогены, такие как полицикличные ароматические углеводороды и 17-бета эстрадиол. В микросомах печени этот фермент вовлечен в НАДФН-зависимый путь переноса электрона.
3. Какую роль играет CYP1B1 в развитии глаукомы
Предполагается, что этот фермент метаболизирует также сигнальную молекулу, вовлеченную в развитие глаза, возможно, стероид, поэтому мутации в гене цитохрома приводят к различным аномалиям строения глаза, в том числе приводящим к глаукоме. То есть данный фермент разлагает молекулу, которая принимает активное участие в правильном формировании угла передней камеры глаза и его фильтрующих структур. Существуют карты метаболизма CYP1B1 эстрадиола, ретинола и бензпирена (например, от компании GeneGo).
4. Описанные мутации в гене CYP1B1
- частота мутаций
- особенности российской популяции
- серьезность последствий различных мутаций
Показано, что от 20 до 50% пациентов с ПОУГ имеют мутации в гене цитохрома P450. Всего описано 4499 вариаций в экзонах и интронах гена CYP1B1, в том числе 16 – обрыв цепи, 36 – сдвиг рамки считывания, 6 вставок в пределах рамки и 134 миссенс варианта. Референсной базы вариаций гена на Российской популяции пока не создано. Общемировая база вариаций гена доступна в GenBank и ensembl.org. В таблице 4 приведены основные аномалии, к которым приводят мутации в гене CYP1B1 и ссылки на статьи.
Таблица 4. Список аномалий, к которым приводят мутации в гене CYP1B1
Заболевание |
Код статьи в базе PubMed |
Врожденная глаукома |
9097971 (4), 18852424 (4), 15475877 (3), 19536304 (3) |
Аномалия Петерса |
16735991 (3), 15682044 (3), 20151268 (1), 16638984 (1) |
Рак молочной железы |
20093341 (6), 15734954 (6), 9823305 (5), 20037207 (5) |
Глаукома |
11774072 (4), 19622003 (3), 15342693 (2), 19668563 (2) |
Синдром Ригера |
16735994 (2), 17106362 (1) |
ПОУГ |
16862072 (1), 19096718 (1), 20198978 (1), 17361544 (1) |
Открытоугольная глаукома |
16319821 (2), 19793111 (2), 17563717 (2), 15342693 (1) |
Опухоль эндометрия |
14656940 (6), 12873984 (6), 15285606 (3), 20492382 (3) |
Химический онкогенез |
12520071 (1) |
5. Подходы к лечению генетических аномалий в гене CYP1B1
Подходы к лечению генетических аномалий в гене CYP1B1 немногочисленны. Предлагается перенос определенным образом запрограммированных стволовых клеток с «диким типом» гена CYP1B1 у пациентов с мутациями с гене CYP1B1 (Choudhary D 2009).
1. Характеристика гена
Ген оптиневрин OPTN расположен на коротком плече 10-й хромосомы в локусе 10p13, длиной 38,2 кб и имеет 16 экзонов. С данного гена синтезируется спирализованная спираль, белок оптиневрин, который играет важную роль в поддержке комплекса Гольджи, экзоцитозе, перемещении мембран посредством взаимодействия с миозином VI , Rab 8 и хангтингтином. Оптиневрин экспрессируется в трабекулярном аппарате, цилиарном теле, сетчатке, мозге, коре надпочечников, в лимфоцитах, фибробластах, скелетных мышцах, сердце, печени, в плаценте и у плода.
Рис. 7. Ген оптиневрин OPTN и его 16 экзонов
С гена оптиневрина считываются 12 различных белков (варианты сплайсинга). При мутациях в гене оптиневрина описаны следующие глазные состояния: первичная открытоугольная глаукома, атрофия зрительных нервов, слепота, офтальмогипертензия, глаукома нормального давления, а также мутации в гене оптиневрина приводят к боковому амиотрофическому склерозу.
2. Функция белка, синтезируемого с гена OPTN в норме и при мутациях
Оптиневрин подавляет индукцию интерферона бета в ответ на инфекцию РНК вирусом. Играет нейропротекторную роль в глазу и зрительном нерве. Возможно, является частью сигнального пути, который сдвигает равновесие в сторону индукции клеточной смерти. Может являться клеточной мишенью для аденовируса Е3 14.7, ингибитора функции TNF -альфа, влияя, таким образом, на клеточную смерть. Взаимодействует с фактором транскрипции IIIA (GTF3A). Взаимодействует с TRAF3, TBK1 и MYO6. Связывается с убиквитином. Следует обратить внимание, что в клетке оптиневрин располагается в основном вокруг ядра и связан с комплексом Гольджи, а также в везикулах рядом с клеточной мембраной.
3. Какую роль играет оптиневрин в развитии глаукомы
При нарушении функции белка оптиневрина из-за мутации в нем координация внутриклеточных структур, связанных с комплексом Гольджи и транспорт в клетке изменяются, что приводит замедлению метаболизма и гибели нервных клеток зрительной системы, давая картину глаукоматозного изменения зрительного нерва в отсутствии повышенного внутриглазного давления.
4. Описанные мутации
- частота мутаций
- особенности российской популяции
- серьезность последствий различных мутаций
Наиболее четкая взаимосвязь между мутацией и развитием нормотензивной глаукомы прослеживается в случае замены глутамина на лизин в 50-м положении (Glu50Lys) rs28939688 из-за замены гуанина на аденин в 458 позиции (458G>A) (Tin Aung, 2005). Также довольно стабильно при мутациях, приводящих к заменам His26Asp, Glu104Asp, Thr202Arg, Ala336Gly, Ala377Thr, His486Arg, Arg545Gln, и c.691-692insAG развивается глаукома.
Что касается остальных полиморфизмов в гене миоцилина, то их достаточно много, они разнообразны и четкой взаимосвязи между мутацией и развитием глаукомной оптической нейропатии выявить пока не удается. В нашей лаборатории мы проводим анализ на наличие замены глутамина на лизин в 50-м положении ( Glu 50 Lys ) rs28939688 путем секвенирования данного участка ДНК.
5. Подходы к лечению генетических аномалий в гене OPTN
Публикаций, подробно рассматривающих подходы к замене мутированного гена CYP1B1 на нормальный или блокировку гена с патологической функцией, я пока не нашла. Однако, на мой взгляд, общие принципы генной терапии в данном случае такие же, как и при коррекции функции других генов, Уже открывается новая эра, новая волна исследований и публикаций об особенностях и последствиях вмешательства в экспрессию генов, приводящих к развитию глаукомы. Дойдет очередь и до оптиневрина, а пока следует лучше разобраться с его функциями, полиморфизмами и клиническими признаками генетических вариаций.
В табл. 5 рассмотрены параметры генов, описанных в статье.
Таблица 5. Длина рассмотренных в статье генов и количество экзонов в них
| |
Размер гена, кб |
Количество экзонов |
Длина экзонов (с какого по какой нуклеотид) |
| MYOC |
17,22 |
3 |
1..626,13912..14037,15925..17217 |
| CYP1B1 |
8,58 |
3 |
1..401,792..1835,4871..8578 |
| OPTN |
38,20 |
16 |
1..221,8057..8208,8881..8934,9016..9207,
10193..10395,12372..12554,16186..16259,
18807..18959,22304..22406,23914..24029,
25337..25486,25865..25958,27664..27822,
31986..32116,33421..33500,36664..38195 |
Диагнозы, при которых показан поиск мутаций в генах MYOC, OPTN и CYP1B1
- MYOC – MIM 601652 ПОУГ ювенильная
- CYP1B1 – MIM 601771 ПОУГ ювенильная
- OPTN – MIM137760 нормотензивная глаукома, атрофия зрительных нервов
Зачем делать генетический анализ на наличие мутаций в генах?
Во-первых, чтобы лечить заболевание наиболее эффективно, нужно его сначала диагностировать, как наставлял Козьма Прутков «зри в корень». Во-вторых, здесь мне хочется привести аналогию с сотовыми телефонами. Согласитесь, удобная вещь, особенно смартфон. Ведь каких-то 20 лет назад люди говорили: «Зачем нам такие дорогие телефонные аппараты, ну и что, если они без провода?» Чем больше пользователей становится у технологии, тем быстрее она развивается. Поэтому каждый проведенный генетический анализ вносит свой вклад в копилку знаний человечества о себе и приближает день, когда мы научимся справляться с глаукомой. Именно поэтому у нас такая гибкая ценовая политика проведения тестов.
Какой биоматериал необходим для проведения анализа?
Любой, содержащий ДНК исследуемого человека: кровь (венозная или капиллярная), букальный эпителий, биопсийный материал или уже непосредственная выделенная ДНК. Наиболее предпочтительным для нас материалом является венозная кровь 2,0 мл + 0,5М ЭДТА.
Как проводится генетическая диагностика:
- Максимально точно диагностируем болезнь по клиническим проявлениям.
- Собираем семейный анамнез встречаемости этой болезни и по возможности проводим данный тест у всех членов семьи с патологией.
- Для более полных и точных результатов генетической диагностики нужно учитывать то обстоятельство, что разные мутации могут приводить к похожим симптомам и при схожем наборе мутаций могут быть разные клинические проявления. Поэтому важно назначать правильный набор тестов, исходя из имеющихся на текущий момент знаний о мутациях, приводящих к болезни и вероятности проявления болезни.
- Проводим забор биоматериала и выделение ДНК
- Секвенируем (узнаем последовательность гена) по методу Сенгера кодирующие участки генов-мишеней
- Сравниваем с референсным геном/генами, отмечаем изменения в гене и степень их влияния на течение болезни
- Выдаем заключение с комментариями, интерпретацией результатов, заключением и рекомендациями.
Заключение:
- Связь мутаций в генах миоцилина (MYOC), цитохрома P450 (CYP1B1) и оптиневрина (OPTN) с развитием глаукомы доказана.
- Разнообразие и особенности мутаций в генах MYOC , CYP1B1 и OPTN в Российской популяции пока не описаны. Есть все основания полагать, что набор мутаций отличается от такового с США, Японии или Скандинавии, что делает актуальной разработку подходящих для России тест-систем.
- Разрабатываются эффективные, нацеленные на устранение причин развития глаукомы методы лечения при мутациях в генах MYOC, CYP1B1 и OPTN . Первые клинические испытания дают обнадеживающие результаты.
Список использованных ресурсов:
- https://sph.uth.edu/Retnet/sum-dis.htm
- www . ensembl . org
- www.ncbi.nlm.nih.gov/genbank
- www.myocilin.com
- www.uniprot.org
- USA patent # US7700575
- Астахов Ю.С., Васильев В.Б., Рахманов В.В. Мутации и полиморфизмы генов миоцилина и оптиневрина: значение для ранней диагностики первичной открытоугольной глаукомы // Клиническая офтальмология. 2005. Т 6. № 2. С. 48–51.
- Бикбов М.М., Суркова В.К., Калентьева А.З., Хуснутдинова Э.К., Джемилева Л.У. Молекулярно-генетический анализ и его значение в диагностике первичной открытоугольной глаукомы. // Российский офтальмологический журнал, 2010, №1
- Aroca - Aguilar J ., S a nchez - S a nchez F ., Mart i nez - Redondo F ., Coca - Prados M ., Escribano J ., Heterozygous expression of myocilin glaucoma mutants increases secretion of the mutant forms and reduces extracellular processed myocilin Molecular Vision 2008; 14:2097-2108
- Baird PN, Richardson AJ, Craig JE, Mackey DA, Rochtchina E, Mitchell P. Analysis of optineurin (OPTN) gene mutations in subjects with and without glaucoma: the Blue Mountains Eye Study. Clin Experiment Ophthalmol. 2004 Oct;32(5):518-22.
- Choudhary D, Jansson I, Schenkman JB. CYP1B1, a developmental gene with a potential role in glaucoma therapy. Xenobiotica. 2009 Aug;39(8):606-15. PMID: 19622003
- Colak D, Morales J, Bosley TM, Al-Bakheet A, Alyounes B, Kaya N, Abu-Amero KK. Genome-wide expression profiling of patients with primary open angle glaucoma. Invest Ophthalmol Vis Sci. 2012 Aug 27;53(9):5899-904. Print 2012. PMID: 22871836
- Gibson J, Griffiths H, De Salvo G, Cole M, Jacob A, Macleod A, Yang Y, Menon G, Cree A, Ennis S, Lotery A. Genome-wide association study of primary open angle glaucoma risk and quantitative traits. Mol Vis. 2012;18:1083-92. PMID: 22605921
- Goldwich A, Baulmann DC, Ohlmann A, Flugel-Koch C, Schocklmann H, Tamm ER. Myocilin is expressed in the glomerulus of the kidney and induced in mesangioproliferative glomerulonephritis. Kidney Int. 2005 Jan;67(1):140-51.
- Fuse N. Genetic bases for glaucoma. Tohoku J Exp Med. 2010;221(1):1-10.
- Kumar A., Basavaraj MG, Gupta SK, et al. Role of CYP1B1, MYOC, OPTN and OPTC genes in adult-onset primary open-angle glaucoma: predominance of CYP1B1 mutations in Indian patients Mol Vis. 2007; 13: 667–676. PMCID: PMC2765475
- Kwon HS, Lee HS, Ji Y, Rubin JS, Tomarev SI. Myocilin is a modulator of Wnt signaling. Mol Cell Biol. 2009 Apr;29(8):2139-54.
- Kwon HS, Tomarev SI. Myocilin, a glaucoma-associated protein, promotes cell migration through activation of integrin-focal adhesion kinase-serine/threonine kinase signaling pathway. J Cell Physiol. 2011 Dec;226(12):3392-402.
- Lander ES, Linton LM, Birren B, Nusbaum C, et al. Initial sequencing and analysis of the human genome. Nature. 2001 Feb 15;409(6822):860-921.
- Mookherjee S, Acharya M, Banerjee D, Bhattacharjee A, Ray K. Molecular Basis for Involvement of CYP1B1 in MYOC Upregulation and Its Potential Implication in Glaucoma Pathogenesis. PLoS One. 2012;7(9):e45077
- Rozsa FW, Reed DM, Scott KM, Gene expression profile of human trabecular meshwork cells in response to long-term dexamethasone exposure. Mol Vis. 2006 Feb 27;12:125-41. PMID: 16541013
- Xin GH, Zhao XH, Liu D, Gong Q, Hou L, Li JY, Pan BR, Li X, Cheng YJ. Effect of VEGF-targeted antisense gene therapy on retinoblastoma cell line SO-RB50 in vitro and in vivo. Int J Ophthalmol. 2012;5(4):440-7.
- Yuan He, Kar Wah Leung, Ye-Hong Zhuo, Jian Ge Pro370Leu mutant myocilin impairs mitochondrial functions in human trabecular meshwork cells Molecular Vision 2009; 15 :815-825.
(с) Марианна Иванова, октябрь 2012 г. |
|